
Mark Teich, editor ejecutivo de la Fundación de Cáncer de Piel, habló con Paul Nghiem, MD, PhD, sobre el reciente progreso histórico en la detección, seguimiento y tratamiento de pacientes con carcinoma de células de Merkel (CCM), un cáncer de piel poco frecuente pero peligroso. El Dr. Nghiem (que se pronuncia NEE-em) es titular de la Cátedra George F. Odland, jefe de Dermatología de la Universidad de Washington en Seattle. Es uno de los mejores expertos en CCM de los Estados Unidos.
Pregunta: El melanoma causa la muerte a más personas que cualquier otra forma de cáncer de piel. Sin embargo, mientras que el carcinoma de células de Merkel (CCM) es mucho menos frecuente que el melanoma, es más peligroso caso por caso. ¿Qué lo hace más peligroso?
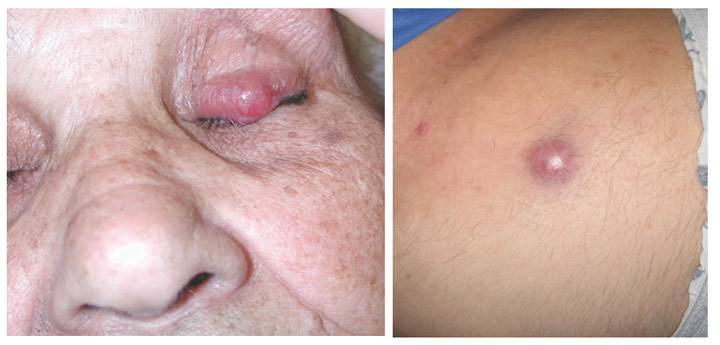
Respuesta: Los CCM en fase temprana suelen ser bastante menos visibles que los melanomas en fase temprana. No parecen importantes, por lo que a menudo acaban siendo detectados en una fase más avanzada, cuando ya han metastatizado (propagado) a otras partes del cuerpo y son bastante más difíciles de curar. Por el contrario, muchos melanomas se detectan en fase in situ (fase 0), cuando están contenidos en la capa más externa de la piel (epidermis) y no han invadido las capas más profundas. Estos melanomas in situ son fáciles de tratar y no tienen prácticamente ninguna posibilidad de metastatizar. Sin embargo, de más de 1.000 casos de CCM que estamos siguiendo, sólo hemos tenido dos lesiones in situ. Es muy raro encontrarlos en una fase temprana.
Cuando se encuentra un melanoma o un tumor de CCM, la primera preocupación es si las células tumorales han podido metastatizar desde el tumor primario a los ganglios linfáticos más cercanos. La forma más frecuente de comprobar esto a día de hoy es la biopsia de los ganglios linfáticos centinela (BGLC). En este análisis, el médico verifica si las células cancerosas se han propagado, o no, a los ganglios linfáticos, mediante la extracción y observación al microscopio de una biopsia de los primeros ganglios que reciben drenaje del fluido linfático del tumor primario. Como sucede en el melanoma, la mayoría de los casos que se observan en fase temprana son pequeños, lo que hace que no se considere necesario realizar una BGLC puesto que sería poco probable que hubieran causado metástasis. Sin embargo, incluso el CCM más pequeño, de unos cuatro o cinco milímetros de diámetro, tiene un 15% de probabilidades de haber alcanzado los ganglios linfáticos o más allá, por lo que consideramos que hay que realizar una BGLC incluso cuando un CCM es muy pequeño.
Pregunta:¿Qué puede hacer la gente para descubrir más lesiones de este tipo cuando aún son fácilmente curables? ¿Cómo pueden reconocer CCM potenciales con mayor antelación?
Respuesta: Las cinco signos clásicos ABCDE del melanoma no sirven en el carcinoma de células de Merkel. En su lugar, tenemos el acrónimo AEIOU, que puede ayudar en la detección temprana: Asintomático/falta de sensibilidad; Expansión rápida; Inmunodepresión; Older/mayores de 50 años; y Ultravioleta-exposición/piel blanca. Un 63% de los pacientes con CCM tiene lesiones que se propagan rápidamente, y cerca del 90% tiene tres o más de las características AEIOU. No obstante, es importante señalar que muchas de las lesiones con varias características AEIOU no resultan ser CCM—algunas son benignas, y otras pueden ser un cáncer de piel diferente.
Pregunta: Una vez que el CCM ha metastatizado a los ganglios linfáticos o más allá, ¿cuál es la probabilidad de supervivencia para el paciente?
Respuesta: Hoy en día es difícil determinar porque, gracias a los nuevos tratamientos, la supervivencia está mejorando rápidamente. Solía sentirme desesperanzado cuando alguien desarrollaba un CCM metastático, pero ahora ya hay esperanza. Ha habido cambios importantes en este campo, y actualmente contamos con la posibilidad de curar o casi-curar CCM avanzados. Ahora pienso que al menos la mitad de los pacientes con CCM metastásico pueden ser tratados de forma efectiva.
Pregunta: ¿Qué tratamientos han marcado la diferencia?
Respuesta: En el pasado, tratábamos carcinomas de células de Merkel avanzados con quimioterapia. Este enfoque reducía los tumores en más de la mitad de los casos, pero la mejoría sólo duraba un promedio de tres meses. Cuando el cáncer volvía, éste era resistente a muchos medicamentos, y el sistema inmune había sido suprimido por la quimioterapia, combinando problemas para un cáncer muy inmunosensible. Sin embargo, los inhibidores de puntos de control son una nueva clase de inmunoterapia muy interesante (tratamientos que aumentan la capacidad del sistema inmunológico para combatir la enfermedad), y se están convirtiendo rápidamente en el estándar de cuidado para CCM avanzados. Al bloquear receptores proteicos que normalmente mantienen el sistema inmunológico bajo control, estos medicamentos estimulan a los linfocitos T para combatir el tumor. En 2014, un inhibidor de punto de control llamado pembrolizumab (Keytruda®), que bloquea un receptor proteico de inhibición inmune llamado PD-1 (por sus siglas en inglés: “programmed death-1”), fue originalmente aprobado para combatir melanomas avanzados, llevando el cáncer de muchos pacientes a una remisión de largo plazo. En la actualidad se está utilizando con éxito como medicamento “sin indicación precisa”; es decir, para un propósito diferente de aquel para el cual se aprobó, en ensayos clínicos sobre el CCM, y está siendo evaluado para ver si es posible aprobarlo en dicha enfermedad. Es importante resaltar que la Administración de Medicamentos y Alimentos de E.E.U.U. aún no ha aprobado ningún medicamento para el tratamiento del CCM.
Los investigadores también están probando una nueva terapia de bloqueo de puntos de control llamada avelumab en pacientes con CCM. Este medicamento estimula los linfocitos T mediante el bloqueo de una molécula llamada PD-L1 que interactúa con PD-1 para inhibir estas células inmunes esenciales.
Diferentes ensayos de cada medicamento están en marcha con pacientes de CCM, y en base a su éxito hasta el día de hoy, estarán cada vez más disponibles. En 2015, la FDA otorgó “vía rápida” y el estado de “terapia revolucionaria” para avelumab con el fin de acelerar su comprobación y desarrollo para conseguir la aprobación de la FDA.
Creemos que tanto pembrolizumab como avelumab tienen posibilidades de ser aprobados para su empleo en el tratamiento del CCM en 2017, ya que es cada vez más evidente que estos agentes son mucho más beneficiosos y seguros que la quimioterapia tradicional.
Solía sentirme desesperanzado por los pacientes con CCM metastásico. Ahora hay esperanza.”
Pregunta: ¿Cuál de estos dos medicamentos ha tenido mejores resultados?
Respuesta: Eso es algo que no se puede determinar porque estos medicamentos han sido analizados en diferentes poblaciones de pacientes (sin quimioterapia previa en el caso de pembrolizumab, y con quimioterapia previa sin éxito para avelumab). Ambos medicamentos bloquean el mismo proceso general de reanimación/estimulación de linfocitos T, por lo que no hay una clara diferencia de efectividad entre estos dos agentes en el presente.
Pregunta: ¿Existe hoy día algún orden preferente en el que se deberían administrar los tratamientos? ¿Hay que administrar primero la quimioterapia o la radiación, y después utilizar una de las terapias de bloqueo de puntos de control?
Respuesta: Hasta hace poco, la quimioterapia era la terapia de primera línea. Pero si se trata un CCM avanzado con un inhibidor de puntos de control antes de administrar la quimioterapia, un 60% de pacientes responden. Si se espera hasta que el paciente haya fallado la primera ronda de quimioterapia, un 40% de pacientes responde; y después de dos o más rondas de quimioterapia, sólo responde un 20%. Por tanto, normalmente, el enfoque adecuado ahora es utilizar el agente bloqueador de puntos de control primero, y decidir qué hacer después en base a la respuesta. Algunos pacientes responderán de forma completa, con una remisión total de la enfermedad. Otros responderán parcialmente, a menudo disminuyendo un 70% del volumen tumoral, lo cual es una respuesta importante. Muchos de estos pacientes acaban teniendo un nivel bajo de enfermedad que no afecta su salud en absoluto. Una mujer que traté recientemente mostró una respuesta parcial durante un año, que más tarde se tornó en una respuesta completa. Pero normalmente, si el medicamento funciona, la respuesta aparece rápidamente, y la mayoría de las respuestas duran bastante más de un año. Sin embargo, no sabemos qué pasará cuando el medicamento deje de administrarse.
Aunque la quimioterapia ya no es el tratamiento de primera línea, la radiación puede ser utilizada en algunos casos como una ventaja al principio, ya que crea una buena sinergia con la inmunoterapia. El sistema inmune elimina mejor tumores pequeños que tumores grandes, y la radiación puede reducir tumores de forma efectiva. Por tanto, es mejor primero irradiar las lesiones más grandes para reducirlas y así disminuir la carga del cáncer antes de utilizar la terapia de bloqueo de puntos de control. De esta manera, el sistema inmune puede eliminar el tumor, reducido, de forma más efectiva.
Pregunta: ¿Qué hay de las otras terapias de bloqueo de puntos de control aprobadas por la FDA para el melanoma, nivolumab (Opdivo®) y la combinación ipilimumab (Yervoy®)-nivolumab?¿Están siendo probadas para el CCM también?
Respuesta: No existen datos publicados sobre estos agentes en CCM, pero se están reclutando pacientes ahora para un nuevo ensayo de la combinación de ipilimumab y nivolumab. Aunque no hay datos oficiales, hemos visto algunos pacientes que han tenido resultados maravillosos con estos agentes también.
Pregunta: ¿Qué ocurre si no funciona ninguna de las terapias iniciales de bloqueo de puntos de control?
Respuesta: Hoy día, éste es un gran campo de interés e investigación. La combinación de dos tipos diferentes de medicamentos inmunoestimuladores es un área importante a explorar. También podría combinarse la inyección local de terapias inmunoestimuladoras,para eliminar un tumor objetivo específico, con un agente sistémico, como por ejemplo una inmunoterapia. También hay interés en combinar la quimioterapia, o la radiación, con terapias de control de puntos de bloqueo, pero estas opciones no han sido estudiadas todavía y no sabemos cuál sería su efectividad.
Pregunta: Usted ha dicho que aproximadamente la mitad de los pacientes obtendrán buenos resultados con las terapias de bloqueo de puntos de control, lo cual sugiere que la otra mitad no obtendrá tales resultados. Dado que estos tratamientos son caros y conllevan algunos efectos secundarios potencialmente graves, ¿existe alguna manera de saber de antemano qué pacientes mostrarán una respuesta positiva, con el fin de poner en marcha desde el principio un tratamiento más beneficioso para aquellos pacientes que no mostrarán respuesta?
Respuesta: A pesar de que más de la mitad de los pacientes responde, para un 40% el cáncer continúa progresando como si no se estuviese administrando ningún tratamiento. Por desgracia, actualmente no podemos asegurar con antelación quién responderá y quién no. Nosotros, y muchos otros, estamos trabajando muy duro para resolver ese problema, pero a día de hoy, ninguno de las docenas de estudios que hemos realizado es más preciso que lanzar una moneda a cara o cruz.
Pregunta: Y después de parar un curso de tratamiento, ¿existe alguna manera de saber con antelación si el cáncer está empezando a reaparecer?
Respuesta: Hemos avanzado mucho en esteaspecto. Nuestro equipo ha desarrollado un análisis de sangre que busca anticuerpos de poliomavirus de células de Merkel en la sangre, con el fin de detectar cualquier recidiva con tiempo, cuando es posible tratar el tumor de forma más efectiva (ver www.merkelcell.org/sero).
En 2008, los Dres. Patrick Moore y Yuan Chang observaron que la mayoría de los carcinomas de células de Merkel son causados en parte por un virus (a menudo la luz solar también juega un papel importante). Este poliomavirus de células de Merkel lo encontramos aproximadamente en el 80% de los tumores de CCM. Cuando este virus infecta una célula, produce oncoproteínas (proteínas que promueven el cáncer), las cuales pueden provocar que la célula se multiplique de manera descontrolada. Realizamos el análisis de sangre en intervalos diferentes, empezando en el momento en que se hace el diagnóstico, y si el número de anticuerpos para estas proteínas depoliomavirus aumenta en algún momento, es un firme indicio de que el paciente está teniendo una recidiva.
Actualmente estamos utilizando este análisis rutinario porque es muy útil en la gestión de pacientes. Aproximadamente la mitad de los pacientes no produce estos anticuerpos, y de hecho tienen un 40% más de riesgo de presentar recidivas comparado con aquellos pacientes que producen los anticuerpos, por lo cual sabemos que es necesario hacer un seguimiento exhaustivo con escáner. Para los pacientes que generan los anticuerpos es relativamente simple: si el cáncer no vuelve, el nivel de anticuerpos cae rápidamente, y en la mayoría de casos es indetectable al cabo de un año después del tratamiento. Si el CCM reaparece, el nivel de anticuerpos aumenta. Eso nos da una gran oportunidad para descubrir recidivas con prontitud, cuando son muy tratables: tratar una uva en lugar de un pomelo (refiriéndonos al tamaño del cáncer) marca una gran diferencia. Y con un paciente cuyos niveles de anticuerpos siguen cayendo, el análisis de sangre nos da la seguridad de que el cáncer no ha recidivado, con lo cual podemos omitir o reducir el uso de costosos escaneos.
Alrededor de una docena de instituciones en todo el país están empleando este análisis actualmente, y un grupo en Europa está desarrollando un análisis similar. Publicamos la primera descripción de nuestro análisis en 2010. Con la ayuda de una subvención del Instituto Nacional de la Salud (NIH), hasta el momento hemos seguido a más de 200 pacientes de CCM recién diagnosticados para comprobar la utilidad de este análisis. Tanto a nosotros como a nuestros pacientes nos ha parecido muy útil, y el segundo gran estudio de validación será publicado en la revista Cancer a finales de 2016.
Pregunta: Después de haber tratado a pacientes de CCM, ¿cómo decide la frecuencia con la que debe verles y qué riesgo hay de que el cáncer vuelva a aparecer?
Respuesta: Durante varios años hemos tenido datos sobre el tiempo que sobreviven los pacientes después de haber sido diagnosticados en las distintas fases de CCM, pero desde hace poco tiempo obtenemos también datos sobre si los pacientes han tenido una recidiva. Para mi sorpresa, esto ha resultado increíblemente útil. Por ejemplo, cuando a los pacientes se les diagnostica por primera vez, se les puede decir que un paciente en fase 3 puede tener un 70% de probabilidad de recidiva, mientras que un paciente en la temprana fase 1 puede tener tan sólo un 20%. Cuando los pacientes visitan a su médico para su chequeo anual, ahora es posible decirles cuánto riesgo ‘residual’ de enfermedad tienen, empleando los datos sobre “supervivencia libre de recidiva” (cuánto tiempo los pacientes viven sin recidiva). Si una lesión no ha recidivado después de tres años, gran parte del riesgo ha desaparecido.
Además, es importante saber que, incluso cuando las lesiones recidivan, la fase en la que el tumor original se encontraba cuando fue diagnosticado juega un papel importante en la gravedad que la recidiva podría presentar. Si bien los pacientes de fase 1 tienen recidivas, éstas suelen estar aún cerca del tumor primario o posiblemente en los ganglios y pueden ser tratados con éxito. Por el contrario, cuando los pacientes de fase 3 tienen recidivas, éstas suelen ser metástasis distantes y mucho más peligrosas.
Ninguno de estos datos estaba disponible hasta hace seis meses, y están resultando ser muy útiles para saber cómo de cerca hay que seguir a los pacientes. Probablemente los hayamos estado siguiendo de forma demasiado agresiva, y durante demasiados años.
En general, ahora creemos que no hace falta hacer un seguimiento de los pacientes ni tan exhaustivo ni durante tantos años como solíamos hacer. El CCM no parece comportarse como el melanoma, el cual a menudo recidiva 5 o 10 años después del diagnóstico. Con el CCM, si reaparece, normalmente ocurre después de dos o tres años. Por tanto, ahora pensamos que el seguimiento intensivo durante dos o tres años es normalmente adecuado, con un calendario bastante menos agresivo hasta el quinto año aproximadamente. Si bien estos datos de no-recidiva no están aún publicados, están disponibles en https://merkelcell.org/prognosis/disease-recurrence/.
Pregunta: ¿Existe algún tipo diferente de tratamiento que esté marcando la diferencia?
Las inmunoterapias de bloqueo de puntos de control han sido las que han cambiado las tornas, y ningún otro tipo de terapia en proceso de estudio ha marcado tal diferencia hasta ahora. Sin embargo, en combinación con la terapia de puntos de control, ahora estamos empleando los linfocitos T del propio paciente, específicos del virus, para combatir el cáncer. En CCM causados por virus, se pueden encontrar rápidamente estos linfocitos T, extraerlos e incubarlos con factores de crecimiento para hacer que vivan más tiempo y sean más efectivos, y después inyectarlos en el paciente. Esto puede estimular el sistema inmunológico, y la combinación de esta terapia con la terapia de bloqueo de puntos de control puede ser más efectiva que las dos por separado.
También estamos investigando la combinación de algunas terapias intralesionales con las terapias de bloqueo de puntos de control. Éstas son inmunoterapias, como interferones, interleucina-12 o agonistas de receptores tipo Toll, que son inyectados directamente en el tumor del paciente. En estudios pequeños con CCM, en muchos casos han reducido o eliminado el tumor inyectado y también otros tumores en otras partes del cuerpo. Los estudios están actualmente en proceso de desarrollo, pero parece probable que algunos de estos inmunoestimuladores ‘locales’, administrados junto con agentes de puntos de control inmunológico, ayudarán a producir mayor tasa de respuesta que los agentes de puntos de control administrados de forma aislada.
